- Efficacité maintenue 4 ans après l’injection dans le cadre de l’étude de phase III REFLECT
- Maintien du bénéfice à 4 ans chez les patients traités bilatéralement : amélioration cliniquement significative d’au moins 15 lettres par rapport à leur nadir observé
- 73 % des patients traités bilatéralement présentent un niveau d’amélioration cliniquement significatif
- Profil de sécurité favorable confirmé à 4 ans
Paris, France, le 20 mars 2024, 7h30 CET — GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible au PEA-PME), une société biopharmaceutique spécialisée dans le développement et la commercialisation de thérapies géniques innovantes pour les maladies rétiniennes neurodégénératives et les troubles du système nerveux central, a publié aujourd’hui les premiers résultats d’efficacité et de sécurité à 4 ans[1] après l’administration du traitement dans le cadre de REFLECT, une étude de phase III portant sur LUMEVOQ® (GS010 ; lenadogene nolparvovec). Les résultats montrent que l’amélioration de l’acuité visuelle s’est maintenue avec un profil de sécurité favorable quatre ans après une administration unique de la thérapie génique. L’injection bilatérale offre un effet supplémentaire par rapport au traitement unilatéral, démontré dans toutes les analyses de l’amélioration de l’acuité visuelle et des taux de répondeurs.
« Les dernières données de l’étude REFLECT confirment que l’amélioration observée avec lenadogene nolparvovec se maintient 4 ans après l’administration du traitement, ainsi que le bénéfice supplémentaire observé chez les participants recevant une injection intravitréenne bilatérale de thérapie génique », a déclaré Patrick Yu-Wai-Man, MD, PhD, professeur d’ophtalmologie à l’Université de Cambridge et au Moorfields Eye Hospital, et investigateur principal international de REFLECT. « Par ailleurs, les participants de l’étude REFLECT ayant reçu une injection bilatérale présentaient un profil de sécurité comparable aux participants traités unilatéralement. »
Les observations renforcent les résultats observés à 3 ans après l’administration du traitement rapportés en mars 2023[2].
Efficacité durable et significative à l’Année 4
L’évolution de l’acuité visuelle au fil du temps montre que l’amélioration visuelle après traitement par lenadogene nolparvovec s’est maintenue sur 4 ans chez tous les patients, l’acuité visuelle des patients ayant reçu une injection bilatérale restant meilleure que celle des patients ayant reçu une injection unilatérale. Cet écart est observé depuis l’Année 1,5.
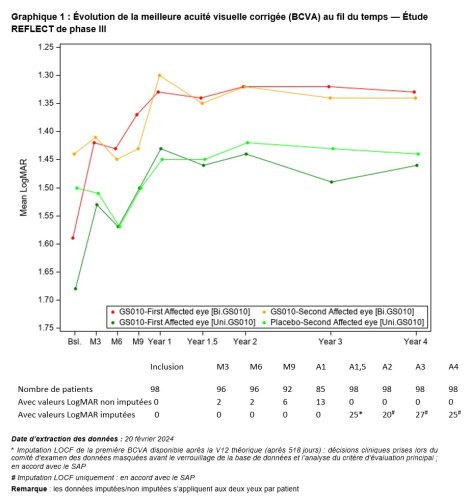
Par rapport au nadir (c.-à-d. la BCVA la plus basse enregistrée entre l’inclusion et l’Année 4), l’acuité visuelle moyenne pour tous les yeux traités par LUMEVOQ a augmenté au-delà du seuil de +15 lettres, qui définit conventionnellement une amélioration cliniquement significative. L’amélioration des yeux des patients ayant reçu le placebo met en évidence l’effet controlatéral du traitement constamment observé dans toutes les études cliniques (également documenté dans les yeux traités par sham dans les études REVERSE1 et RESCUE2)
« L’effet durable sur la vision, observé dans l’essai clinique REFLECT, est une pièce essentielle du parcours de LUMEVOQ pour les patients, les médecins et les autorités de santé », a commenté Laurence Rodriguez, directrice générale de GenSight Biologics. « L’impact durable d’une administration unique différencie la thérapie génique des autres modalités de traitement en facilitant l’observance des patients et en améliorant la qualité de vie. »

Les analyses des répondeurs renforcent l’observation de l’amélioration clinique des patients, pour lesquels l’évolution naturelle entraîne généralement une altération importante de la vision avec une très faible probabilité de récupération spontanée.3 Quatre ans après une injection bilatérale, 73 % des patients présentaient une amélioration cliniquement significative d’au moins -0,3 LogMAR (+15 lettres ETDRS) par rapport à leur nadir observé. Quatre-vingt-un pour cent (81 %) des patients traités bilatéralement sont capables de lire des lettres à l’écran (vision « on-chart »), la probabilité d’atteindre ce niveau de vision étant deux fois plus élevée avec un traitement bilatéral qu’avec une injection unilatérale (rapport de probabilité : 2,0 [0,7 ; 5,5]).
Profil de sécurité favorable
Le profil de sécurité favorable de LUMEVOQ® a continué à être confirmé et a été démontré comme étant comparable chez les patients traités bilatéralement et unilatéralement. Aucun arrêt de l’étude lié à des événements indésirables systémiques ou oculaires et aucun événement indésirable oculaire grave n’ont été enregistrés. Le principal événement indésirable oculaire était une inflammation intraoculaire, généralement légère, et répondant au traitement conventionnel.
REFLECT est une étude de phase III randomisée, en double insu, contrôlée contre placebo, incluant 98 patients présentant une perte visuelle due à une neuropathie optique héréditaire de Leber (NOHL) causée par un gène mitochondrial ND4 muté ; les patients ND4 inclus présentaient une perte visuelle jusqu’à un an depuis son apparition. Tous les patients ont reçu une injection intravitréenne (IVT) de lenadogene nolparvovec dans leur premier œil affecté. Le deuxième œil affecté a été randomisé pour recevoir une deuxième IVT de LUMEVOQ® ou une IVT de placebo, qui a été administrée le même jour ou le jour suivant. 48 patients ont été randomisés pour recevoir un traitement bilatéral par LUMEVOQ®, et 50 pour recevoir un traitement unilatéral par lenadogene nolparvovec (premier œil affecté traité par LUMEVOQ®, deuxième œil affecté traité par placebo). Les patients REFLECT seront suivis jusqu’à 5 ans après l’injection afin de surveiller l’efficacité et la sécurité de LUMEVOQ® au fil du temps.
Références :
- Yu-Wai-Man P, Newman NJ, Carelli V, Moster ML, Biousse V, Sadun AA, et al. Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci Transl Med. (2020) 12:eaaz7423. doi: 10.1126/scitranslmed.aaz7423
- Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, Biousse V, Vignal-Clermont C, et al. Efficacy and safety of intravitreal gene therapy for Leber hereditary optic neuropathy treated within 6 months of disease onset. Ophthalmology. (2021) 128:649–60. doi: 10.1016/j.ophtha.2020.12.012.
- Newman NJ, Carelli V, Taiel M, Yu-Wai-Man P. Visual outcomes in Leber hereditary optic neuropathy subjects with the m.11778G>A (MTND4) mitochondrial DNA mutation. J Neuro-Ohthalmol. (2020) 40:547–57. doi: 10.1097/WNO.0000000000001045.
[1] Date d’extraction des données : 20 février 2024
[2] « GenSight Biologics confirme le maintien de l’efficacité et de la tolérance d’une injection bilatérale de LUMEVOQ® après 3 ans dans l’essai de phase III REFLECT », communiqué de presse financière, 13 mars 2023
Contacts
-
LifeSci AdvisorsRelations InvestisseursGuillaume van Renterghem+41 (0)76 735 01 31