- Efficacité maintenue trois ans après injection : amélioration statistiquement significative de l’acuité visuelle par rapport au nadir
- Bénéfice continu chez les patients traités bilatéralement avec une amélioration de +17 à +20 lettres ETDRS par rapport au nadir à 3 ans
- 62% des patients traités bilatéralement et qui étaient « off-chart » à la baseline repassent « on-chart » à 3 ans
- Bon profil de sécurité confirmé à 3 ans
Paris, France, le 13 mars 2023, 7h30 CET – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique spécialisée dans le développement et la commercialisation de thérapies géniques innovantes pour les maladies neurodégénératives rétiniennes et les troubles du système nerveux central, annonce aujourd’hui des résultats d’efficacité et de tolérance à 3 ans[1] post-injection de LUMEVOQ® (lenadogene nolparvovec) dans l’essai clinique de phase III REFLECT. Les résultats montrent le maintien de l’efficacité et de la tolérance d’une injection intravitréenne bilatérale de la thérapie génique avec une amélioration de l’acuité visuelle statistiquement significative par rapport à la baseline dans les deux yeux traités, montrant un bénéfice additionnel d’une injection bilatérale par rapport à une injection unilatérale.
« L’essai REFLECT a fourni une nouvelle série de résultats démontrant le bénéfice durable du lenadogene nolparvovec, tout en reconfirmant son profil de sécurité », a déclaré le Dr Nancy J. Newman, professeur d’ophtalmologie et de neurologie à la faculté de médecine de Emory University (Atlanta, Etats-Unis) et investigateur principal international de REFLECT. « De plus, le bénéfice supplémentaire chez les patients traités bilatéralement suggère que l’injection dans les deux yeux pourrait être la meilleure option pour les patients atteints de NOHL et présentant la mutation ND4. »
Ces résultats renforcent ceux observés 2 ans après l’administration du traitement, qui ont été rapportés en décembre 20211, et 1,5 an après l’administration du traitement, rapportés en juin 2021.
Conçu dans le cadre d’un Special Protocol Assessment (SPA) avec la US FDA, REFLECT est un essai de phase III randomisé, double-masqué, et contrôlé versus placebo, qui inclut 98 sujets présentant une perte de vision due à la Neuropathie Optique Héréditaire de Leber (NOHL) causée par une mutation du gène mitochondrial ND4 ; et dont la durée de perte de vision à l’inclusion dans l’étude était de moins d’un an. La mutation mitochondriale ND4 est associée à la forme clinique la plus grave de NOHL, avec de mauvais pronostics visuels.1 Tous les sujets ont reçu une injection intravitréenne (IVT) de LUMEVOQ® dans leur premier œil affecté. Le deuxième œil affecté a été randomisé pour une deuxième IVT de LUMEVOQ® ou de placebo, administrée le jour-même ou le lendemain. 48 sujets ont été randomisés dans le bras de traitement bilatéral par LUMEVOQ®, et 50 dans le bras de traitement unilatéral par LUMEVOQ® (premier œil affecté traité par LUMEVOQ®, deuxième œil affecté traité par placebo).
Efficacité soutenue et significative à 3 ans
L’évolution de l’acuité visuelle dans le temps montre que l’effet du lenadogene nolparvovec est maintenu jusqu’à 3 ans pour tous les sujets, avec un bénéfice additionnel de l’injection bilatérale par rapport à l’injection unilatérale. Les analyses à 3 ans confirment l’effet dose constaté à 1,5 ans et à 2 ans, avec une différence absolue de l’acuité visuelle moyenne entre les bras de +6,5 lettres ETDRS en faveur des sujets traités bilatéralement à 3 ans.
Graphique 1 : Variation de l’acuité visuelle (BCVA) au fil du temps


Tableau 1 : Variation de l’acuité visuelle (BCVA) par rapport au nadir, 3 ans après injection
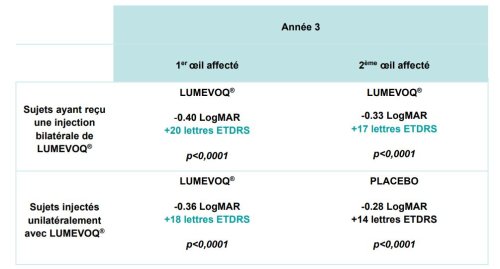
Data cut-off : 28 nov. 2022. Sujets traités bilatéralement : 1er œil atteint : n=48 ; 2ème œil atteint : n=48 ; sujets traités unilatéralement : 1er œil atteint : n=50 ; 2ème œil atteint : n=50.
La comparaison avec le nadir (c.à.d. : la moins bonne acuité visuelle enregistrée entre la baseline et la troisième année) démontre clairement l’efficacité du lenadogene nolparvovec, même pour les yeux sous placebo qui se sont améliorés grâce à un effet controlatéral du traitement (également documenté dans les yeux traités par injection simulée (sham injection) dans les essais REVERSE2 et RESCUE3).
Les analyses des répondeurs soulignent les avantages du traitement pour les patients qui auraient autrement subi une perte de vision importante avec une très faible probabilité de récupération spontanée (récupération partielle chez 11 % des patients décrits dans la littérature).1 Trois ans après une injection bilatérale, 73% des patients ont présenté une amélioration cliniquement significative d’au moins -0,3 LogMAR (+15 lettres ETDRS) par rapport à leur nadir observé et, parmi les patients qui n’étaient pas capables de lire des lettres sur le tableau au départ (valeurs off-chart pour les deux yeux), 62% sont maintenant capables de lire des lettres.
Un profil de tolérance favorable
Le profil de tolérance favorable du lenadogene nolparvovec continue de se confirmer, avec un profil de tolérance du traitement comparable chez les sujets traités bilatéralement et unilatéralement. Il n’y a pas eu d’interruption de l’étude liée à un événement indésirable systémique ou oculaire, et aucun événement indésirable oculaire grave n’a été rapporté. Le principal événement indésirable oculaire était l’inflammation intraoculaire, la plupart du temps d’intensité légère et répondant au traitement conventionnel.
Les patients de REFLECT seront suivis jusqu’à 5 ans après injection afin de contrôler l’efficacité et la tolérance du lenadogene nolparvovec au fil du temps.
« Nous sommes très heureux de constater que les résultats de l’étude REFLECT après trois ans de suivi confirment l’efficacité durable et significative du lenadogene nolparvovec, en particulier chez les patients traités bilatéralement », a déclaré Bernard Gilly, Directeur Général et Co-fondateur de GenSight Biologics. « L’ensemble des preuves cliniques démontre de façon convaincante que cette thérapie génique représente un réel espoir pour les patients atteints de cette maladie cécitante dévastatrice. Ces dernières données apporteront un soutien supplémentaire important à l’examen en cours de notre dossier par l’EMA. »
Références:
- Newman NJ, Carelli V, Taiel M, Yu-Wai-Man P. Visual outcomes in Leber hereditary optic neuropathy subjects with the m.11778G>A (MTND4) mitochondrial dna mutation. J Neuroophthalmol. (2020) 40:547–57. doi: 10.1097/WNO.0000000000001045.
- Yu-Wai-Man P, Newman NJ, Carelli V, Moster ML, Biousse V, Sadun AA, et al. Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci Transl Med. (2020) 12:eaaz7423. doi: 10.1126/scitranslmed.aaz7423
- Newman NJ, Yu-Wai-Man P, Carelli V, Moster ML, Biousse V, Vignal-Clermont C, et al. Efficacy and safety of intravitreal gene therapy for Leber hereditary optic neuropathy treated within 6 months of disease onset. Ophthalmology. (2021) 128:649–60. doi: 10.1016/j.ophtha.2020.12.012.
Contacts
-
LifeSci AdvisorsRelations InvestisseursGuillaume van Renterghem+41 (0)76 735 01 31
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74