Paris, France, le 11 décembre 2019, 7h30 CET – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui les premiers résultats de l’étude observationnelle REALITY, ainsi qu’une analyse des données de phase III REVERSE et RESCUE, qui mettent en évidence le mauvais pronostic des patients souffrant d’une perte de vision due à une neuropathie optique héréditaire de Leber (NOHL) associée à la mutation ND4. Les résultats confirment les observations des experts de la NOHL dans leur pratique clinique et contrastent fortement avec l’amélioration bilatérale observée dans les études de phase III du LUMEVOQ™ (GS010).
« Les études d’histoire naturelle de la NOHL ont été difficiles à mener par le passé. Ces résultats s’ajoutent à l’ensemble des connaissances et réaffirment le consensus selon lequel, à de rares exceptions près, la NOHL est caractérisée par une perte de vision fulgurante avec très peu de chances d’amélioration au cours des premières années. » déclare le Dr. Mark Moster, Service de Neuro-Ophtalmologie, Wills Eye Hospital, Professeur de Neurologie et d’Ophtalmologie à l’Université Thomas Jefferson, Philadelphie, PA, et Investigateur Principal des études RESCUE et REVERSE. « L’absence d’amélioration chez les sujets REALITY est en contraste frappant avec les améliorations observées chez nos patients REVERSE et RESCUE. »
REALITY est une étude observationnelle rétrospective et transversale de sujets atteints de NOHL, menée dans des centres à travers l’Espagne, l’Italie, la France, le Royaume-Uni et les États-Unis. L’objectif est de générer des informations sur l’histoire naturelle de la maladie sur la base d’une approche qui faciliterait les comparaisons avec REVERSE et RESCUE. L’étude vise à inclure 50 sujets d’ici le second trimestre 2020.
L’analyse intermédiaire de REALITY, basée sur les 15 sujets atteints de la mutation ND4 âgés d’au moins 15 ans au début de la maladie et qui ont été inclus dans l’étude avant septembre 2019, montre la chute dramatique et généralement irréversible de l’acuité visuelle typiquement observée chez les patients atteints de NOHL associée à la mutation ND4. Contrairement aux sujets inclus dans REVERSE et RESCUE, qui ont tous reçu une injection unilatérale de LUMEVOQ™, l’acuité visuelle moyenne chez les sujets REALITY ne s’est pas améliorée après le déclin initial.
Figure 1. Histoire naturelle de la NOHL dans l’analyse intermédiaire de REALITY vs. Evolution de l’acuité visuelle dans REVERSE et RESCUE
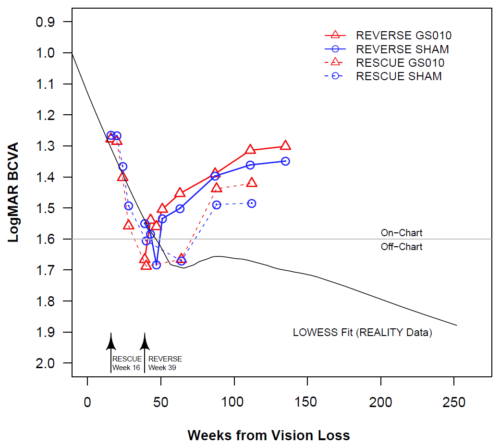
Remarque : BCVA = acuité visuelle (Best Corrected Visual Acuity). La ligne LOWESS pour REALITY (n = 15 sujets) est basée sur une série de régressions polynomiales autour de chaque point de données. Les régressions utilisent un intervalle limité en arrière et en avant et donnent moins de poids aux points distants. L’évolution dans le temps de l’acuité visuelle pour REVERSE et RESCUE utilise la moyenne des moindres carrés basée sur une analyse de modèle mixte ANCOVA. Les points de départ des courbes sont définis sur la durée moyenne entre le début de la maladie et le moment du traitement (16 semaines pour RESCUE, 39 semaines pour REVERSE).
« Ces résultats soulignent à quel point les améliorations visuelles observées dans REVERSE et RESCUE sont remarquables. » commente Bernard Gilly, Co-fondateur et Directeur Général de GenSight. « Ces résultats soutiendront nos efforts pour fournir aux autorités réglementaires les informations les plus solides possibles sur l’histoire naturelle de la maladie, afin de pouvoir démontrer de manière convaincante le bénéfice thérapeutique offert par LUMEVOQ™. »
Une seconde analyse, dérivée des valeurs d’acuité visuelle initiales avant traitement (baseline) des patients REVERSE et RESCUE, montre que les yeux atteints depuis plus longtemps avaient une moins bonne acuité visuelle avant traitement.
Figure 2. Acuité visuelle avant l’injection (baseline) chez les patients REVERSE et RESCUE, en fonction du temps écoulé depuis le début de la perte de vision
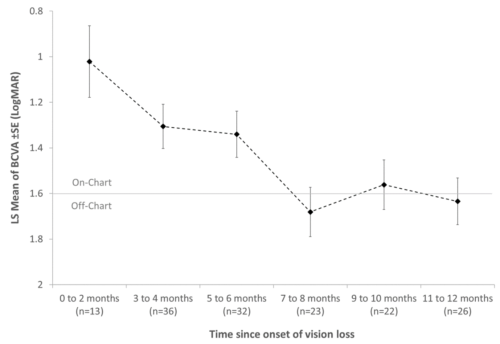
Remarque : Les yeux des patients REVERSE et RESCUE ont été classés en fonction du temps écoulé entre le début de la perte de vision et l’acuité visuelle initiale (un jour avant l’injection). Les n représentent le nombre d’yeux dans chaque groupe. De par le protocole des études, le début de la perte de vision est au maximum de 12 mois avant injection. La moyenne pour chaque groupe représente la moyenne des moindres carrés des valeurs d’acuité visuelle en LogMAR. L’axe des ordonnées montre une échelle LogMAR inversée pour représenter une baisse de vision par une ligne verticale descendante.
La courbe de baisse d’acuité visuelle est basée sur des données transversales, mais reste toutefois cohérente avec la tendance observée dans l’analyse intermédiaire de REALITY.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, LUMEVOQ™ (GS010), est en Phase III pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare qui conduit à une perte irréversible de la vue chez les adolescents et les jeunes adultes. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de LUMEVOQ™ (GS010)
LUMEVOQ™ (GS010) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne du Médicament (EMA) en octobre 2018.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesurera la différence d’efficacité de GS010 entre les yeux traités et les yeux non-traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, seront utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluront l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Également, une évaluation de la proportion de patients « répondeurs » sera réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluront également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio-dissémination, et de réponse immunitaire post-injection.
Les études sont actuellement menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux États-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les résultats à 96 semaines de suivi des deux études ont été publiés en 2019. Les patients ont ensuite été transférés vers une étude de suivi à long terme pour 3 années supplémentaires.
Identifiants ClinicalTrials.gov :
REVERSE : NCT02652780
RESCUE : NCT02652767
À propos de REFLECT
REFLECT est une étude multicentrique, randomisée, en double aveugle, contrôlée contre placebo visant à évaluer l’innocuité et l’efficacité des injections bilatérales de GS010 chez des sujets atteints de NOHL associée à la mutation NADH déshydrogénase 4 (ND4).
L’essai a inclut 90 patients présentant un début de perte de vision depuis moins d’un an et est mené dans plusieurs centres en Europe et aux États-Unis.
Dans le bras actif, GS010 est administré en une seule injection intravitréenne aux deux yeux de chaque sujet. Dans le bras placebo, GS010 est administré en une seule injection intravitréenne au premier œil affecté, tandis que l’autre œil reçoit une injection placebo.
Le critère d’évaluation principal de l’étude REFLECT est la BCVA exprimée en LogMAR mesurée un an et demi après traitement dans le deuxième œil affecté / non encore affecté. Le changement par rapport aux valeurs initiales chez les deuxièmes yeux affectés / non encore affectés recevant GS010 et le placebo est la principale réponse d’intérêt. Les critères d’efficacité secondaires incluent : BCVA reporté dans LogMAR à 2 ans après le traitement dans le deuxième œil affecté / non encore affecté par rapport au placebo et au premier œil affecté recevant GS010, PTOM, sensibilité aux couleurs et au contraste et échelles de qualité de vie. Le premier patient a été traité en mars 2018, et le recrutement a pris fin en juillet 2019, en avance sur les prévisions.
Identifiants ClinicalTrials.gov :
REFLECT : NCT03293524
À propos de REALITY
REALITY est une étude observationnelle rétrospective et transversale multinationale de sujets atteints de NOHL, basée sur les dossiers médicaux et l’administration d’enquêtes sur la qualité de vie liée à la santé (HRQoL), ainsi que les coûts directs et indirects associés à la maladie.
L’étude vise à recruter au moins 50 sujets (adultes et pédiatriques) principalement dans les pays suivants : Espagne, Italie, France, Royaume-Uni et États-Unis.
Les principaux objectifs de l’étude REALITY sont les suivants : décrire l’évolution des changements fonctionnels et structurels visuels, ainsi que d’autres symptômes associés chez les patients atteints de NOHL ; comprendre l’impact de la perte de vision liée à la NOHL sur la HRQoL ; et comprendre les impacts économiques pour les patients et leurs familles découlant des coûts directs et indirects associés à la maladie. L’objectif secondaire est de décrire la relation entre les facteurs génétiques, de style de vie et / ou environnementaux et l’expression du phénotype NOHL.
Le premier sujet a été recruté le 3 janvier 2018, et le recrutement devrait prendre fin au début du second trimestre 2020.
ClinicalTrials.gov Identifiers:
REALITY LHON Registry: NCT03295071
Contacts
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74