- Les yeux traités par GS010 montrent une récupération continue des fonctions visuelles depuis le nadir (point bas de la vision après traitement) à la fois d’acuité visuelle (BCVA) et de sensibilité aux contrastes (CS)
- Les yeux traités recouvrent 21 lettres ETDRS depuis le nadir à la semaine 72
- Les améliorations bilatérales de la fonction visuelle corroborent l’évolution parallèle des yeux traités et non-traités (sham) déjà observée dans les études RESCUE et REVERSE
- L’acuité visuelle moyenne des yeux traités et sham est passée de off-chart à 48 semaines à on-chart à 72 semaines
- 40 % des yeux traités et sham ont atteint une amélioration d’acuité visuelle depuis le nadir cliniquement significative (au moins 0,3 LogMAR ou 15 lettres ETDRS) après 72 semaines
- GS010 est toujours rapporté comme étant sûr et bien toléré après 72 semaines
Paris, France, le 17 avril 2019, 7h30 CET – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui les résultats de suivi à 72 semaines de l’étude clinique de Phase III RESCUE, qui évalue la sécurité et l’efficacité d’une seule injection intra-vitréenne de GS010 (rAAV2/2-ND4) chez 39 patients atteints de neuropathie optique héréditaire de Leber (NOHL) induite par la mutation 11778-ND4, et chez qui la perte d’acuité visuelle a débuté moins de 6 mois avant le traitement. Les patients ont reçu GS010 dans un œil et une procédure sham dans l’autre œil (injection simulée). Le traitement était randomisé entre l’œil le moins atteint (« meilleur œil ») et le plus atteint (« moins bon œil »).
La mesure essentielle de la fonction visuelle — l’acuité visuelle (best-corrected visual acuity, ou BCVA) — a continué à s’améliorer à la semaine 72 par rapport à la semaine 48, démontrant une récupération continue depuis le point le plus bas de la vision, ou nadir, atteint durant la phase aiguë de la maladie. À la semaine 72, les yeux traités par GS010 s’étaient améliorés de -0,413 LogMAR (+21 lettres ETDRS) depuis le nadir, contre une amélioration à la semaine 48 de -0,257 LogMAR (+13 lettres ETDRS). Cette récupération à 72 semaines n’a pas encore pu compenser entièrement la détérioration depuis la baseline et tout au long de la phase aiguë : les yeux traités par GS010 étaient toujours inférieurs de 0,192 LogMAR (-10 lettres ETDRS) à la baseline, comparé à 0,380 LogMAR (-19 lettres ETDRS) à 48 semaines.
Figure 1. Évolution de la variation d’acuité visuelle par rapport à la baseline jusqu’à 72 semaines en lettres ETDRS dans RESCUE
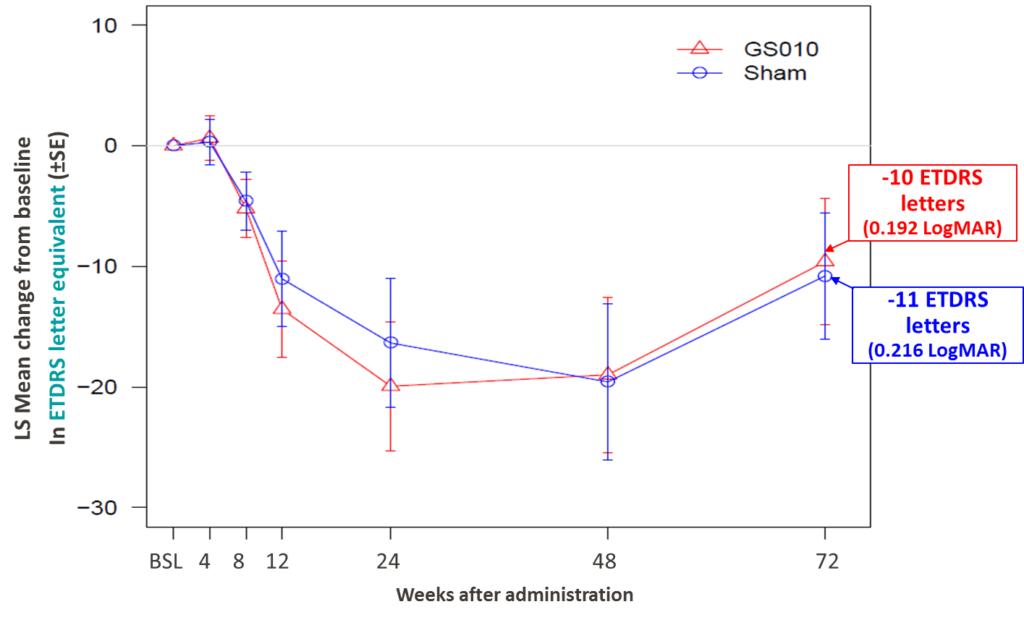
De manière cohérente avec tous les résultats obtenus jusqu’à présent dans les études RESCUE et REVERSE, les yeux sham ont montré une évolution de l’acuité visuelle suivant étroitement celle des yeux traités par GS010. À la semaine 72 de RESCUE, les yeux sham s’étaient améliorés de -0,435 LogMAR depuis le nadir (+22 lettres ETDRS). La courbe en U suit donc très étroitement celle des yeux traités par GS010, ce qui signifie qu’une différence statistiquement significative d’acuité visuelle n’a pas pu être démontrée entre les yeux traités par GS010 et les yeux sham.
L’importance de la récupération bilatérale a fait passer l’acuité visuelle moyenne dans les deux groupes d’yeux de off-chart à la semaine 48 à on-chart à la semaine 72. De plus, 40 % des yeux traités par GS010 et des yeux sham ont atteint une amélioration cliniquement significative de -0,3 LogMAR (+15 lettres ETDRS) depuis le nadir. De même, 58 % des yeux traités par GS010 et 50 % des yeux sham ont atteint une amélioration cliniquement significative de -0,2 LogMAR (+10 lettres ETDRS) depuis le nadir.
Figure 2. Évolution de l’acuité visuelle en LogMAR jusqu’à 72 semaines dans RESCUE
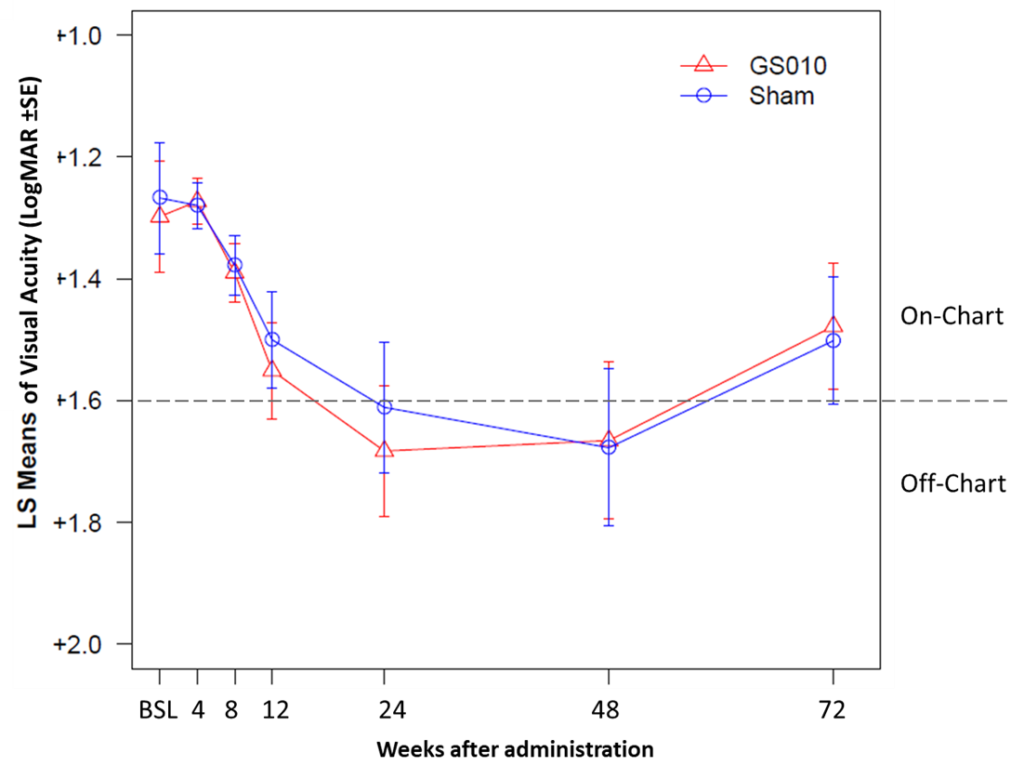
Remarque : LS Means = Least Squares Means, ou Moyennes des Moindres Carrés
Tableau 1. Variation de l’acuité visuelle BCVA depuis le nadir*
(LogMAR et lettres ETDRS)
| Acuité visuelle en LogMAR | Lettres ETDRS | |||||
| Semaine 48 | Semaine 72 | Semaine 48 | Semaine 72 | |||
| N | Moyenne (ET) | n | Moyenne (ET) | |||
| Tous les yeux traités par GS010 | 36 | -0,257
(0,358) |
-0,413
(0,527) |
34 | +12,8
(17,9) |
+20,6
(26,3) |
| Tous les yeux sham | 36 | -0,236
(0,319) |
-0,435
(0,501) |
33 | +11,8
(15,6) |
+21,7
(25,1) |
Remarque : *Selon le plan d’analyse statistique (SAP), le nadir a été défini comme la valeur LogMAR après traitement la plus faible jusqu’à la semaine d’intérêt. La vision Light Perception/No Light Perception, ou LP/NLP, n’a pas été incluse dans l’analyse.
La sensibilité aux contrastes (contrast sensitivity, CS), une seconde mesure de la fonction visuelle, a évolué de manière similaire à l’acuité visuelle : si les valeurs pour les yeux traités par GS010 et les yeux sham sont restées inférieures aux valeurs de baseline, la sensibilité aux contrastes est également remontée de sorte que l’écart par rapport à la baseline a diminué à la semaine 72 par rapport à la semaine 48. Les deux groupes d’yeux ont suivi une trajectoire parallèle, de sorte que la différence entre leurs valeurs de CS n’a pas été statistiquement significative.
Figure 3. Évolution de la sensibilité aux contrastes en LogCS jusqu’à 72 semaines dans RESCUE
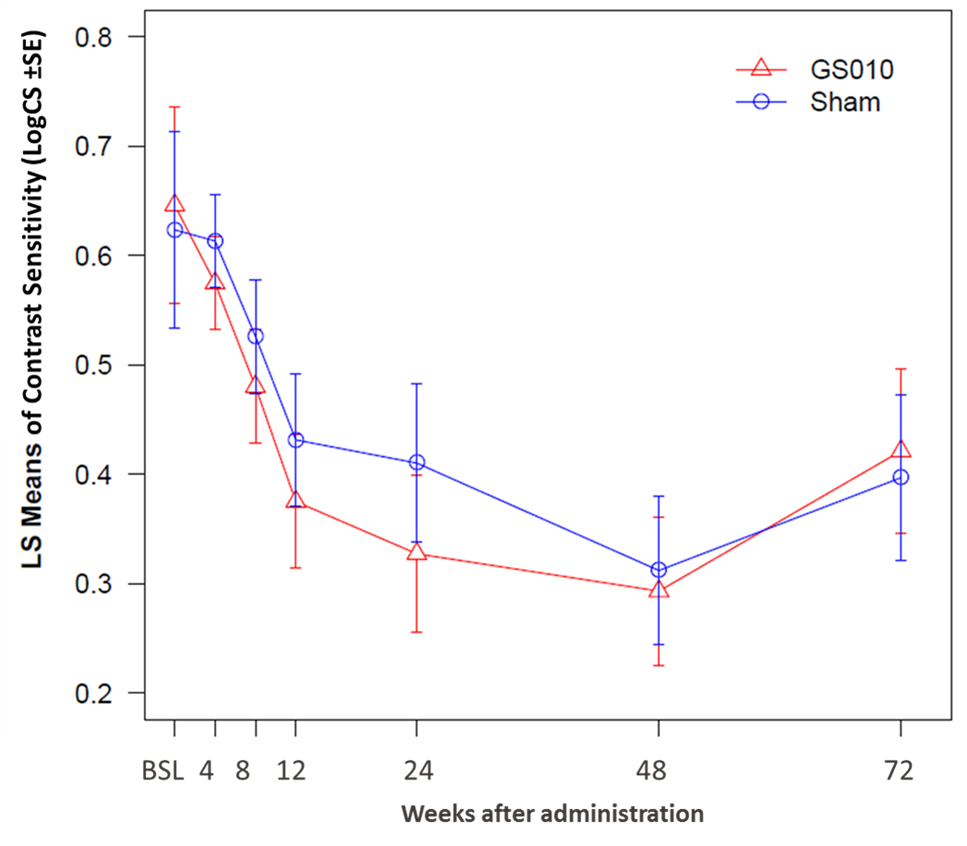
Remarque : LS Means = Least Squares Means, ou Moyennes des Moindres Carrés
Tableau 2. Variation de la sensibilité aux contrastes par rapport à la baseline
(logCS)
| Semaine 48 | Semaine 72 | |||
| N | Moyenne des moindres carrés (erreur standard) | n | Moyenne des moindres carrés (erreur standard) | |
| Yeux traités par GS010 | 36 | -0,34
(0,07) |
38 | -0,25
(0,07) |
| Yeux sham | 36 | -0,32
(0,07) |
38 | -0,28
(0,07) |
Remarque : Un modèle mixte d’analyse de covariance (ANCOVA) a été utilisé avec la variation à la semaine 72 par rapport à la baseline comme réponse.
« Cette amélioration de la fonction visuelle entre les semaines 48 et 72, à la fois de l’acuité visuelle et de la sensibilité aux contrastes, renforce notre conviction des effets bénéfiques de GS010, observant le passage de l’acuité visuelle moyenne de off-chart à on-chart à 72 semaines. Ces résultats tendent à montrer une évolution plus favorable que ce que nous observons habituellement dans la pratique chez les patients NOHL ND4 », a commenté le Dr Catherine Vignal, Chef du Service de Neuro-Ophtalmologie à la Fondation Rothschild, et Investigateur Principal au Centre Hospitalier National d’Ophtalmologie des XV-XX, Paris.
Une différence a été observée entre les résultats obtenus jusqu’à présent dans les études REVERSE et RESCUE de GS010, elle concerne les observations anatomiques. Les données obtenues jusqu’à présent n’indiquent pas de différence de protection de l’anatomie des yeux traités par GS010 : dans les yeux traités par le médicament et les yeux sham, l’anatomie concernée, observée par diverses mesures OCT (épaisseur de la couche des fibres nerveuses rétiniennes, épaisseur du faisceau papillomaculaire, volume de la couche des cellules ganglionnaires), a continué à s’amincir à la semaine 72, même si le taux d’amincissement a diminué entre la semaine 48 et la semaine 72. Parmi les mesures OCT utilisées dans l’étude, le volume maculaire ETDRS a montré une différence entre les yeux traités par GS010 et les yeux sham (0,096 mm3, p = 0,0012).
« Par définition, la population dans RESCUE est très hétérogène, et la structure de leur rétine est également très variable, allant d’une atrophie marquée des fibres nerveuses à un œdème. Au moment de démasquer l’étude, ce qui arrivera après 96 semaines, nous pourrons séparer nos sujets en fonction de leurs mesures d’OCT à baseline. Dans le sous-groupe présentant un œdème, l’amincissement dans le temps sera un bon résultat. Dans le sous-groupe présentant une atrophie des fibres nerveuses, une augmentation de l’épaisseur sera un bon résultat. Ce mix de mesures OCT à l’inclusion masque les véritables résultats OCT à 72 semaines de RESCUE », a commenté le Dr Robert C. Sergott, Directeur, Wills Eye Hospital, Neuro-Ophtalmologie et Directeur, William H. Annesley, Jr, EyeBrain Center, Thomas Jefferson University, Philadelphie, PA, Etats-Unis.
L’analyse préliminaire des données de sécurité a montré que GS010 a été bien toléré pendant 72 semaines. Il n’y a eu aucun événement indésirable oculaire sérieux, ni aucune sortie d’étude en raison de problèmes oculaires. Les événements indésirables oculaires les plus fréquemment rapportés étaient liés à la procédure d’injection. Une élévation transitoire de la pression intraoculaire a parfois été observée, et attribuée à l’inflammation intraoculaire probablement liée à l’administration de GS010. Ces épisodes ont répondu au traitement standard, sans laisser de séquelles. Il n’y a eu aucun événement indésirable systémique sérieux, et aucune sortie d’étude en raison du traitement ou de la procédure.
« Il est enthousiasmant et gratifiant de voir un tableau de récupération durable et continue de la fonction visuelle émerger des résultats de RESCUE à la semaine 72 », a indiqué Bernard Gilly, cofondateur et directeur général de GenSight. « Les résultats continuent d’être cohérents avec ce qui a pu être observé dans REVERSE à 48 et 72 semaines, et dans RESCUE à 48 semaines. Ils confortent notre confiance dans les bénéfices que GS010 peut délivrer aux patients et nous motivent à travailler avec les autorités pour amener GS010 sur le marché le plus tôt possible. »
Les patients de RESCUE seront de nouveau évalués à 96 semaines, puis les données seront démasquées, permettant de conduire des analyses plus détaillées au niveau individuel. Les résultats de RESCUE à la semaine 96 devraient être disponibles d’ici la fin du troisième trimestre 2019. Les données à la semaine 96 de l’étude REVERSE sont attendues plus tôt, en mai 2019.
La troisième étude interventionnelle de GS010, REFLECT, est un essai de phase III randomisé, en double masqué et contrôlé par placebo, qui vise à évaluer la sécurité et l’efficacité d’injections bilatérales de GS010 chez les patients ayant perdu la vue depuis moins d’un an des suites de la NOHL. Le premier patient de REFLECT a été traité en mars 2018.
La Société tiendra une conférence téléphonique aujourd’hui, 17 avril 2019, à 10h00 CEST en français, et à 14h30 CEST (8h30 EST) en anglais, afin de discuter ces résultats.
Webcast & Conférence téléphonique en français
Numéros de la conférence téléphonique (appel local) :
- France: +33 (0) 1 7037 7166
- Royaume-Uni: +44 (0) 20 3003 2666
- Code: GenSight
Lien Webcast : https://channel.royalcast.com/webcast/gensightbiologicsfr/20190417_1/
Webcast & Conférence téléphonique en anglais
Numéros de la conférence téléphonique (appel local) :
- Etats-Unis: +1 212 999 6659
- France: +33 (0) 1 7037 7166
- Royaume-Uni: +44 (0) 20 3003 2666
- Code: GenSight
Lien Webcast : https://channel.royalcast.com/webcast/gensightbiologicsen/20190417_1/
Une rediffusion de la conférence téléphonique et du webcast sera disponible en utilisant les liens ci-dessus.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, GS010, est en Phase III pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare qui conduit à une perte irréversible de la vue chez les adolescents et les jeunes adultes. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de GS010
GS010 cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesurera la différence d’efficacité de GS010 entre les yeux traités et les yeux non-traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, seront utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluront l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Également, une évaluation de la proportion de patients « répondeurs » sera réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluront également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio-dissémination, et de réponse immunitaire post-injection.
Les études sont actuellement menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux États-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les résultats à 96 semaines de suivi des deux études sont attendus en 2019. Les patients seront ensuite transférés vers une étude de suivi à long terme pour 3 années supplémentaires.
Identifiants ClinicalTrials.gov :
REVERSE : NCT02652780
RESCUE : NCT02652767
À propos de REFLECT
REFLECT est une étude multicentrique, randomisée, en double aveugle, contrôlée contre placebo visant à évaluer l’innocuité et l’efficacité des injections bilatérales de GS010 chez des sujets atteints par la LHON en raison de la mutation NADH déshydrogénase 4 (ND4).
L’essai prévoit de recruter 90 patients présentant un début de perte de vision d’une durée d’un an et qui sera mené dans plusieurs centres en Europe et aux États-Unis.
Dans le bras actif, GS010 sera administré en une seule injection intravitréenne aux deux yeux de chaque sujet. Dans le bras placebo, GS010 sera administré en une seule injection intravitréenne au premier œil affecté, tandis que l’autre œil recevra une injection placebo.
Le critère d’évaluation principal de l’étude REFLECT est la BCVA signalée dans LogMAR après un an de traitement dans le deuxième œil affecté / non encore affecté. Le changement par rapport aux valeurs initiales chez les deuxièmes yeux affectés / non encore affectés recevant GS010 et le placebo sera la principale réponse d’intérêt. Les critères d’efficacité secondaires incluent : BCVA reporté dans LogMAR à 2 ans après le traitement dans le deuxième œil affecté / non encore affecté par rapport au placebo et au premier œil affecté recevant GS010, PTOM, sensibilité aux couleurs et au contraste et échelles de qualité de vie. Le premier patient a été traité en mars 2018.
Identifiants ClinicalTrials.gov :
REFLECT: NCT03293524
Contacts
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74