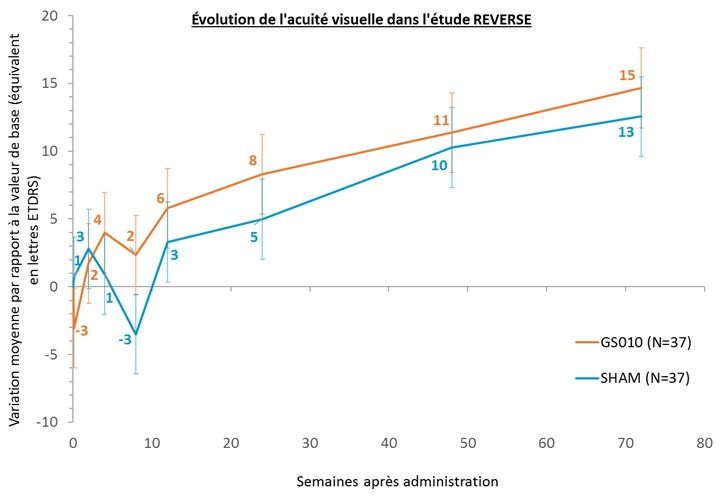
- Amélioration cliniquement significative de +15 lettres ETDRS d’acuité visuelle dans les yeux traités à 72 semaines
- L’acuité visuelle et la sensibilité aux contrastes continuent de s’améliorer de façon bilatérale
- Une proportion significativement plus élevée d’yeux traités atteignent une amélioration cliniquement significative de la sensibilité aux contrastes
- L’effet neuroprotecteur de GS010 est confirmé par la préservation de l’anatomie de la rétine dans les yeux traités
Paris, France, le 18 octobre 2018, 7h30 CEST – GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui des résultats additionnels à 72 semaines de l’étude clinique de Phase III REVERSE, qui évalue la sécurité et l’efficacité d’une seule injection intra-vitréenne de GS010 (rAAV2/2-ND4) chez 37 patients atteints de neuropathie optique héréditaire de Leber (NOHL) induite par la mutation 11778-ND4, et chez qui la perte d’acuité visuelle a débuté entre 6 et 12 mois avant le traitement.
A 72 semaines, une amélioration cliniquement significative de +15 lettres (-0,294 LogMAR) d’acuité visuelle moyenne, comparée à la baseline, a été observée dans les yeux traités par GS010. Une amélioration controlatérale de +12 lettres (-0,246 LogMAR)[1] a été observée dans les yeux sham (injection simulée). Cette progression, qui vient confirmer la tendance positive observée à 48 semaines, témoigne d’un bénéfice fonctionnel maintenu pour les sujets de l’étude.
Une amélioration continue de la sensibilité aux contrastes, telle que déterminée par le test de faibles contrastes de Pelli-Robson, a également été observée. A 72 semaines, les yeux traités et sham présentaient un gain moyen de +0,21 LogCS et +0,15 LogCS comparé à la baseline, respectivement. La proportion des yeux traités atteignant une amélioration cliniquement significative d’au moins 0,3 LogCS (45,9%) était statistiquement supérieure à celle des yeux sham (24,3% ; p=0,0047).
Les bénéfices fonctionnels observés sont complétés par la démonstration que GS010 préserve la structure anatomique de la rétine des yeux traités. A 72 semaines, la tomographie haute résolution par cohérence optique dans le domaine spectral (SD-OCT) a objectivement démontré la préservation dans le temps de l’anatomie de la rétine affectée dans la NOHL dans les yeux traités. Tout d’abord, le volume maculaire des cellules ganglionnaires a été préservé (+0,000 mm3) dans les yeux traités, alors que les yeux sham se sont détériorés par rapport à leur baseline (-0,044 mm3). La différence était statistiquement significative (p=0,0060). Les yeux traités ont également montré une perte limitée d’épaisseur du quadrant temporal de la couche de fibres nerveuses rétiniennes de -1,6 µm, comparée à une perte de -3,6 µm dans les yeux sham (p=0,0521).
“Un tel niveau d’amélioration d’acuité visuelle et de sensibilité aux faibles contrastes, et la préservation des cellules ganglionnaires de la rétine, maintenus dans le temps, et à ce stade de la maladie, sont très encourageants, et bien éloignés de ce qui a été observé et rapporté dans l’histoire naturelle de la NOHL,” a commenté le Dr. Mark L. Moster, Neuro-Ophtalmologie, Wills Eye Hospital et Professeur de Neurologie et d’Ophtalmologie à la Thomas Jefferson University, Philadelphia, PA, Etats-Unis, et Investigateur Principal dans les études cliniques REVERSE et RESCUE.
“La fonction visuelle continue de progresser un an et demi après le traitement par GS010, et dans le même temps, des tests objectifs continuent de démontrer l’effet neuroprotecteur sur la rétine des yeux traités. Ceci est évidemment un formidable bénéfice pour les patients et leurs familles,” a déclaré Bernard Gilly, Directeur Général de GenSight Biologics. “Ces résultats viennent renforcer encore notre détermination à travailler avec les autorités réglementaires pour mettre GS010 sur le marché dans les délais annoncés.”
Comme prévu par le protocole clinique, les 37 sujets seront à nouveau évalués à 96 semaines, et ces résultats sont attendus au second trimestre 2019.
Les premiers résultats à 48 semaines de suivi de RESCUE, la seconde étude clinique de Phase III de GS010 dans le traitement de la NOHL, sont attendus au début du 1er trimestre 2019.
[1] Un modèle mixte de mesures répétées (MMRM) a été utilisé pour l’analyse de l’évolution de l’acuité visuelle en fonction du temps illustrée dans le graphique ci-contre. Un modèle mixte d’analyse de covariance (ANCOVA) a été utilisé pour l’analyse du critère principal de l’étude. Les deux modèles statistiques utilisent des covariables différentes, ce qui explique les éventuels écarts d’arrondi du résultat en lettres ETDRS.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée à la découverte et au développement de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, GS010, est en Phase III pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare qui conduit à une perte irréversible de la vue chez les adolescents et les jeunes adultes. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de GS010
GS010 cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes pivotales de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesurera la différence d’efficacité de GS010 entre les yeux traités et les yeux non-traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, seront utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluront l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Egalement, une évaluation de la proportion de patients « répondeurs » sera réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluront également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio-dissémination, et de réponse immunitaire post-injection.
Les études sont actuellement menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux Etats-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les premiers résultats à 48 semaines de suivi de RESCUE sont attendus au début du 1er trimestre 2019.
Identifiants ClinicalTrials.gov :
REVERSE: NCT02652780
RESCUE: NCT02652767
Contacts
-
Orpheon FinanceInvestisseurs ParticuliersJames Palmer+33 7 60 92 77 74